El cloroformo también denominado triclorometano o tricloruro de metano
CHCl3, a temperatura ambiente es un liquido volátil, no inflamable e incoloro
de olor penetrante , dulzón y crítico.
DESCUBRIMIENTO:
El cloroformo fue descubierto en 1883 por tres químico
Samuel Gthiere
Eugene Sobeiran
Justus von Liebig
Fue usado pronto en la medicina pero solo en pocas ocasiones de histeria , disnea , asma, neuralgias o cáncer.
Luego en 1847 el químico David Waldie sugirió la posibilidad de anestesiar con este compuesto y lo pusieron aprueba y se extendió rápidamente por Inglaterra
Tiempo después Dr. Juan Magaz se dio cuenta de los peligros de la anestesia con cloroformo ya que había puesto en peligro la vida de personas se dejo de utilizar como anestésico.
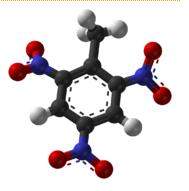
ESTRUCTURA
Tiene 5 átomos: 3 de cloro 1 de hidrógeno y 1 de carbono
Tiempo después Dr. Juan Magaz se dio cuenta de los peligros de la anestesia con cloroformo ya que había puesto en peligro la vida de personas se dejo de utilizar como anestésico.
ESTRUCTURA
Tiene 5 átomos: 3 de cloro 1 de hidrógeno y 1 de carbono
Es un compuesto que puede descomponerse de manera lenta debido a la combinación de la acción que ejercen sobre el, tanto el oxígeno como la luz del sol, por lo que se debe conservar en recipientes de vidrio con coloración oscura y mantener alejado de la luz. Esta acción consigue transformarlo en COCl2 (fosfeno) y HCl (cloruro de hidrógeno), ambos compuestos más tóxicos que el cloroformo, a través de la ecuación:
2CHCl3 + O2 → 2COCl2 + 2 HCl
APLICACIONES:
APLICACIONES:
-En la química se utiliza para la separación orgánica
-Para la fabricar plásticos se usa de unión
-En síntesis orgánica
- En la fabricación de un antiadherente , el teflon
-También se puede usar como arma química
-También se puede utilizar como anestésico
RIESGOS :
Puede causar irregularidades en los latidos del corazón llegando incluso a provocar la muerte
Afecta también a los riñones hígado y una alta concentracion del mismo puede causar dolor de cabeza problemas gastrointestinales como los vómitos por este motivo se dejo de utilizar como anestésico en las salas de operaciones